Hierzulande bestimmt das Pharmaunternehmen, wann und zu welchem Preis ein Produkt auf den Markt kommt. Diese Regelung sorgt zum einen für eine zuverlässige Versorgung mit neuen Arzneimitteln in Deutschland. Sie begünstigt allerdings auch die hohen Ausgaben, da der vom Unternehmen selbst festgesetzte Preis sechs Monate lang von allen Krankenkassen bezahlt werden muss. Erst danach greift der mit dem GKV-Spitzenverband vereinbarte AMNOG-Erstattungsbetrag. Die Geltung des Wunschpreises ab Inverkehrbringen stärkt auch die Verhandlungsmacht der Unternehmen in den Erstattungsbetragsverhandlungen und begünstigt zudem über die internationale Preisreferenzierung hohe Preise für Arzneimittel in der ganzen Welt.
AMNOG als Innovationsbremse?
Trotz dieser günstigen Ausgangslage kritisiert die Pharmaindustrie das AMNOG-Verfahren vehement als innovationsfeindlich. Dabei schwingt oft der Vorwurf mit, dass Patientinnen und Patienten besonders werthaltige Therapien durch die Regulierung vorenthalten werden. Dem ist mitnichten so, wie ein Blick auf die Fakten zeigt. Mit Stand vom 1. Januar 2023 hat der GKV-Spitzenverband 445 Arzneimittel erfasst, die seit 2011 neu eingeführt wurden bzw. als Bestandsmarktprodukte das AMNOG-Verfahren durchlaufen haben. Einige dieser Arzneimittel wurden aufgrund geringfügiger Umsätze von der Nutzenbewertung freigestellt, sodass die Unternehmen ihren Wunschpreis ohne Preisverhandlung selbst festlegen konnten. Manche Arzneimittel befinden sich aktuell noch in der Nutzenbewertungsphase. Für die übrigen 389 Arzneimittel liegt zum Stichtag ein Beschluss zur Nutzenbewertung seitens des Gemeinsamen Bundesausschusses (G-BA) vor.
Deutschland ist europäischer Spitzenreiter bei der Verfügbarkeit neuer Arzneimittel
Im europäischen Vergleich hat Deutschland bei der Quote verfügbarer Arzneimittel den Spitzenplatz inne. So zeigt eine Analyse des europäischen Pharmaverbands (EFPIA), dass in Deutschland zum 1. Januar 2022 92 Prozent aller zwischen 2017 und 2020 europaweit zugelassener Arzneimittel verfügbar waren. Auf den Plätzen 2 und 3 folgen Dänemark (81 Prozent) sowie Österreich und Italien (jeweils 79 Prozent). England und Frankreich liegen mit 68 bzw. 66 Prozent weit dahinter.
Jedes zehnte AMNOG-Arzneimittel wurde vom Markt genommen
In Deutschland sind heute insgesamt 47 AMNOG-Arzneimittel nicht mehr regulär auf dem Markt erhältlich. Somit haben pharmazeutische Unternehmen gut jedes zehnte dieser Arzneimittel wieder vom deutschen Markt genommen. Die Gründe für diese Marktrücknahmen sind vielschichtig.
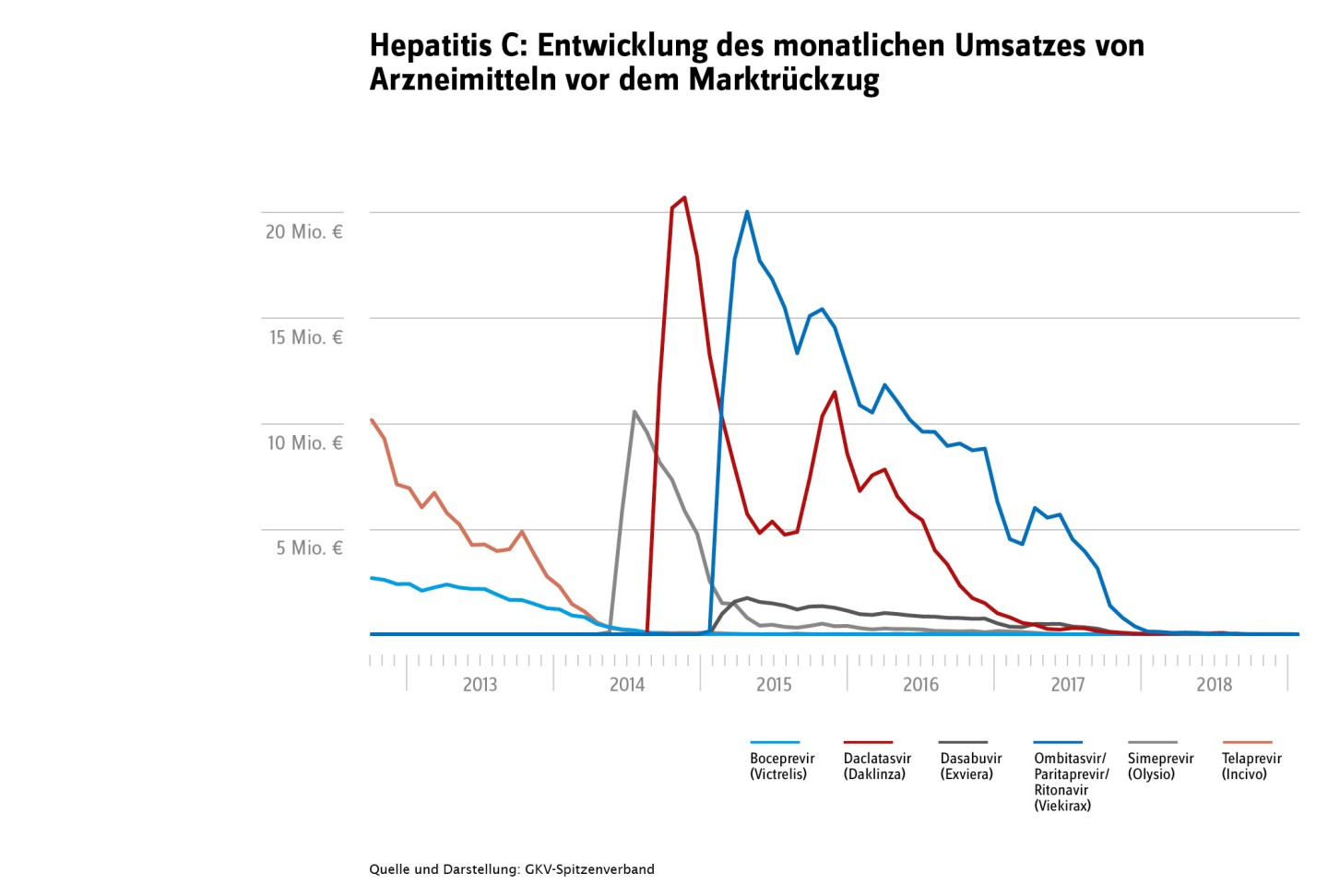
Medizinischer Fortschritt führt teilweise zum Rückzug älterer Substanzen
In manchen Therapiegebieten schreitet der medizinische Fortschritt besonders rasch voran, sodass eine vor Kurzem noch als Innovation beworbene Therapie bereits wenige Jahre später von neuen, wirksameren Arzneimitteln abgelöst wird. Ein Beispiel für diese Entwicklung ist das Therapiegebiet Hepatitis C: Sechs der Neueinführungen sind nicht mehr verfügbar und wiesen vor dem jeweiligen Marktrückzug auch deutliche Umsatzrückgänge in kurzer Zeit auf, wie die untenstehende Abbildung in Bezug auf diese sechs Arzneimittel zeigt. Doch sicher ist: Diese Marktrücknahmen haben keine negativen Auswirkungen auf die Versorgung der Patientinnen und Patienten, da modernere Arzneimitteln an ihre Stelle traten.