Diese Zusatznutzenfiktion garantiert einen Premiumpreis - auch für Arzneimittel, die aufgrund zahlreicher Zulassungserweiterungen über die ursprüngliche Orphan-Indikation hinaus zeigen, dass sie einer Privilegierung kaum bedurft hätten. Da es keine vom Gemeinsamen Bundesausschuss (G-BA) bestimmte zweckmäßige Vergleichstherapie gibt, beruht der Erstattungsbetrag oftmals allein auf europäischen Listenpreisen. Folgen der Erstzulassung als Orphan Drug-Indikationen mit höheren Patientenzahlen, bleibt das hohe Erstrunden-Preisniveau meist erhalten.
Ein Beispiel: Im Jahr 2014 wurde Ramucirumab zunächst als Orphan Drug gegen Magenkrebs zugelassen und verhandelt. Die Jahrestherapiekosten verzehnfachten sich gegenüber bisherigen Standardtherapien in Höhe von rd. 8.000 auf 86.272,03 Euro. Der Orphan Drug-Status entfiel, als 2016 die Zulassung in der Lungen- und Darmkrebstherapie folgte. Bei der nun durchgeführten Vollbewertung konnte der G-BA nur in einer von zwei ehemaligen Orphan Drug-Teilindikationen einen Anhaltspunkt für einen geringen Zusatznutzen feststellen. Die neuen Anwendungsgebiete wiesen keinerlei Zusatznutzen auf. Gleichwohl liegen die Kosten auf einem Niveau, das andere Arzneimittel in der Onkologie nur mit Zusatznutzen in weiten Teilen ihres Zulassungsumfanges erreichten - und das bei erheblichem Umsatzwachstum trotz überwiegend negativen G-BA-Votums. Ein Ausgleich für das erste Jahr, in dem der freigewählte Listenpreis in jedem Fall nutzeninadäquat hoch war, fehlt im Gesetz. Daher fordert der GKV-Spitzenverband die Rückwirkung des Erstattungsbetrages ins erste Jahr.
Neue Dimensionen: ATMPs (Advanced Therapy Medicinal Products)
Die sogenannten Neuartigen Therapien im Bereich der stratifizierten Medizin, auch ATMPs (Advanced Therapy Medicinal Products) stoßen in ganz neue Dimensionen vor: Charakteristisch für sie ist die einmalige Anwendung zu extrem hohen Kosten bei In-Aussichtstellen einer Heilung. Die Kosten für das onkologische Gentherapeutikum Tisagenlecleucel (Kymriah®) belaufen sich auf 320.000 Euro pro Anwendung. Hinzu kommt eine potenziell fünfstellige Summe für die medizinische Vor – und Nachbehandlung der Patientinnen und Patienten oder die Behandlung von Nebenwirkungen. Aufgrund herabgesetzter Zulassungsbedingungen ist die Datenlage zum Patientennutzen unsicher. Offen sind ebenfalls die Nebenwirkungen der Behandlung, ihre Häufigkeit und Schwere.
Um der Unsicherheit Rechnung zu tragen, stehen Modelle erfolgsabhängiger Vergütung im Raum. Denkbar sind z. B. Ratenzahlungen in Abhängigkeit vom konkret messbaren Behandlungserfolg bzw. –misserfolg. Derzeit eignen sich jedoch weder die dem GKV-Spitzenverband zur Verfügung stehenden Daten für die Detektion des Behandlungserfolges noch existieren an die Unternehmen gerichtete Meldeanforderungen für die Abbildung solcher erfolgsorientierten Vertragsmodelle in den Preis – und Produktverzeichnissen.
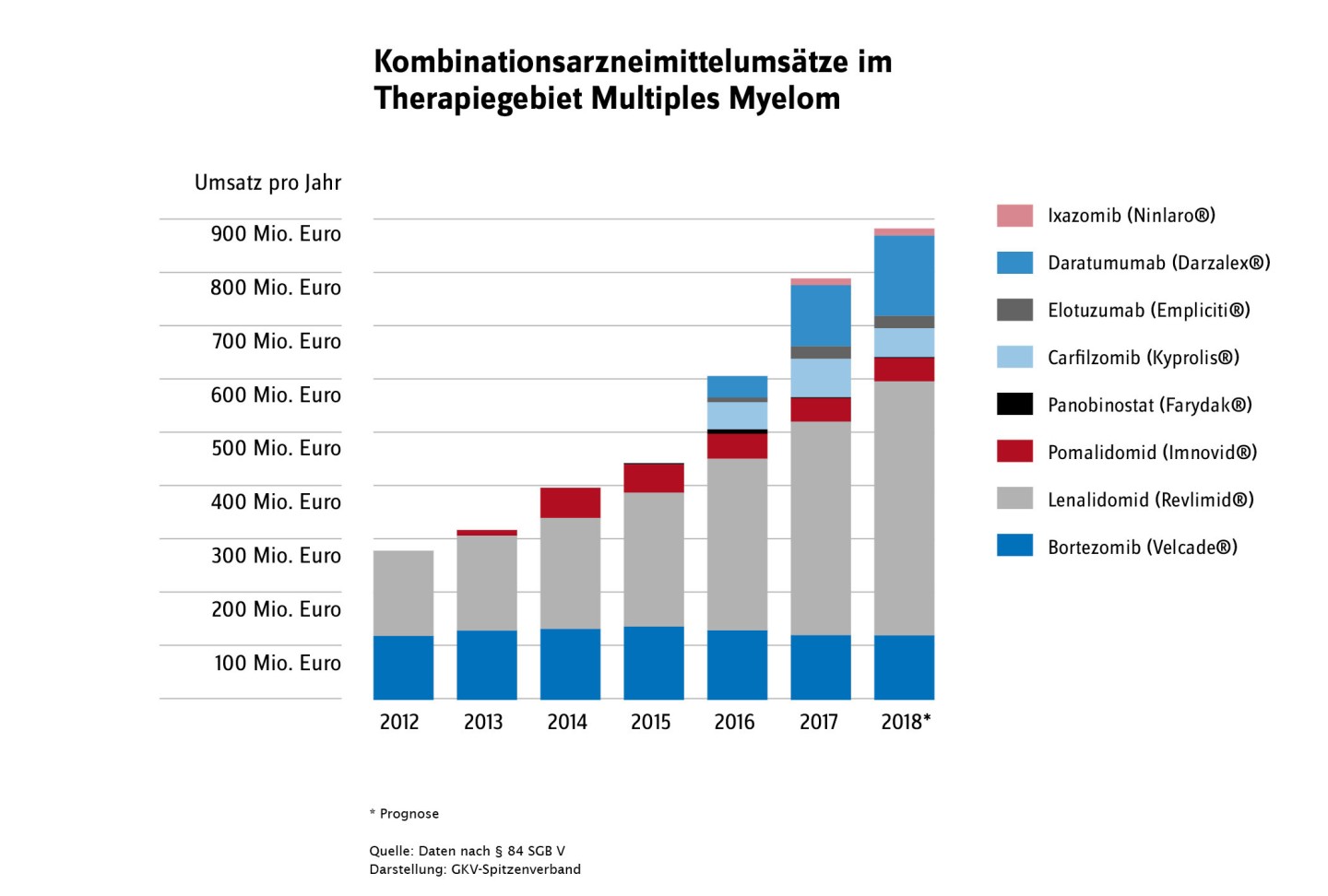
Kostensteigerungen durch Kombinationstherapien
Der Trend in der Onkologie, Wirkstoffe mit anderen Wirkstoffen frei zu kombinieren, führt dazu, dass sich die Kosten der Einzelwirkstoffe meist addieren (1 + 1 ≈ 2), der dazugewonnene Nutzen aber weit hinter einer Addition zurückbleibt (1 + 1 < 2). Während beispielsweise mit der 2007 zur Therapie im Multiplen Myelom zugelassenen Kombination aus Lenalidomid und Dexamethason ein medianes Überleben von 39,6 Monaten zu Jahrestherapiekosten von 97.500 Euro erreicht werden kann, verspricht die 2016 zugelassene Kombination Elotuzumab, Lenalidomid und Dexamethason ein medianes Überleben von 43,7 Monaten (also ein Mehr an 3,9 Monaten), kostet aber 185.469 Euro.
Dies ist Konsequenz der derzeitigen Gesetzesvorgabe, einen Zuschlag auf die Kosten der zweckmäßigen Vergleichstherapie auszuhandeln. Durch den Verzicht des Gesetzgebers auf die Bewertung des Bestandsmarktes setzen sich zudem unbewertete Preisniveaus im AMNOG-Markt fort. Manch älterer Wirkstoff erfährt durch Kombination mit neuen Arzneimitteln nochmals einen signifikanten Umsatzschub (s. Abbildung 3). Bei den Kombinationstherapien besteht also dringend Handlungsbedarf im Bereich Nutzenbewertung und Preissteuerung. (she)