Um die Entwicklung von Arzneimitteln gegen seltene Erkrankungen, sogenannten Orphan Drugs, zu fördern, bestehen für diese Arzneimittel Sonderregelungen im Rahmen der Zulassung und Nutzenbewertung: Seit 2011 werden im sogenannten AMNOG-Verfahren neu in den Markt kommende Wirkstoffe einer Nutzenbewertung unterzogen. Anschließend finden auf Basis dieser Bewertung Preisverhandlungen statt. Für Arzneimittel, die von der Europäischen Kommission als Orphan Drug zugelassen wurden, gibt es eine Besonderheit: Für sie wird der Zusatznutzen bereits durch die Zulassung als belegt angesehen (das sogenannte Orphan-Privileg). Wenn allerdings mit einem Orphan Drug innerhalb eines 12-Monats-Zeitraumes ein Bruttoumsatz von mehr als 30 Millionen Euro erwirtschaftet wird, wird ein reguläres AMNOG-Nutzungsbewertungsverfahren durchgeführt. Diese Grenze lag zuvor bei 50 Millionen Euro und wurde im Jahr 2022 durch das GKV-Finanzstabilisierungsgesetz (GKV-FinStG) auf 30 Millionen Euro abgesenkt. Dadurch werden nun mehr Wirkstoffe einer regulären Nutzenbewertung unterzogen. Aktuell werden im Gemeinsamen Bundesausschuss (G-BA) noch mehrere Beschlüsse vorbereitet, die aufgrund dieser Änderung nötig wurden.
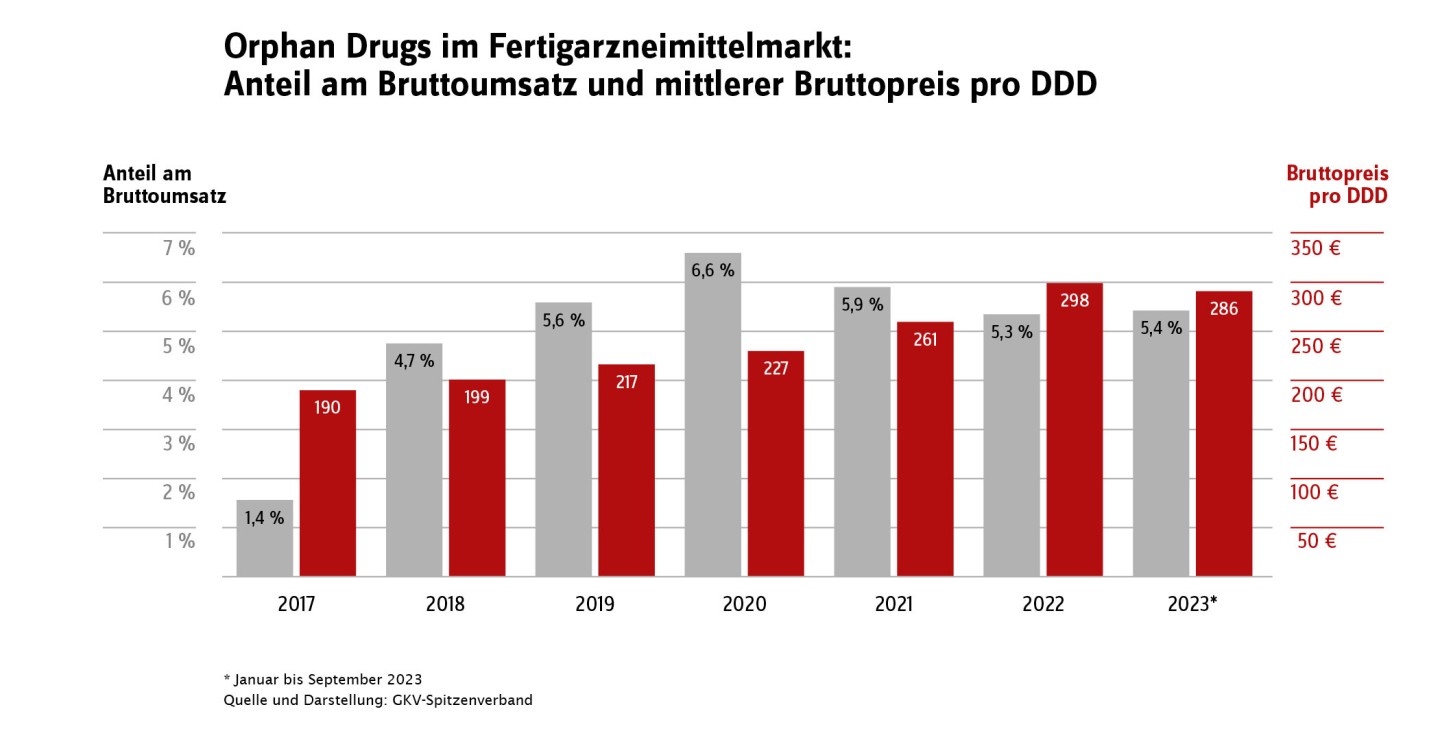
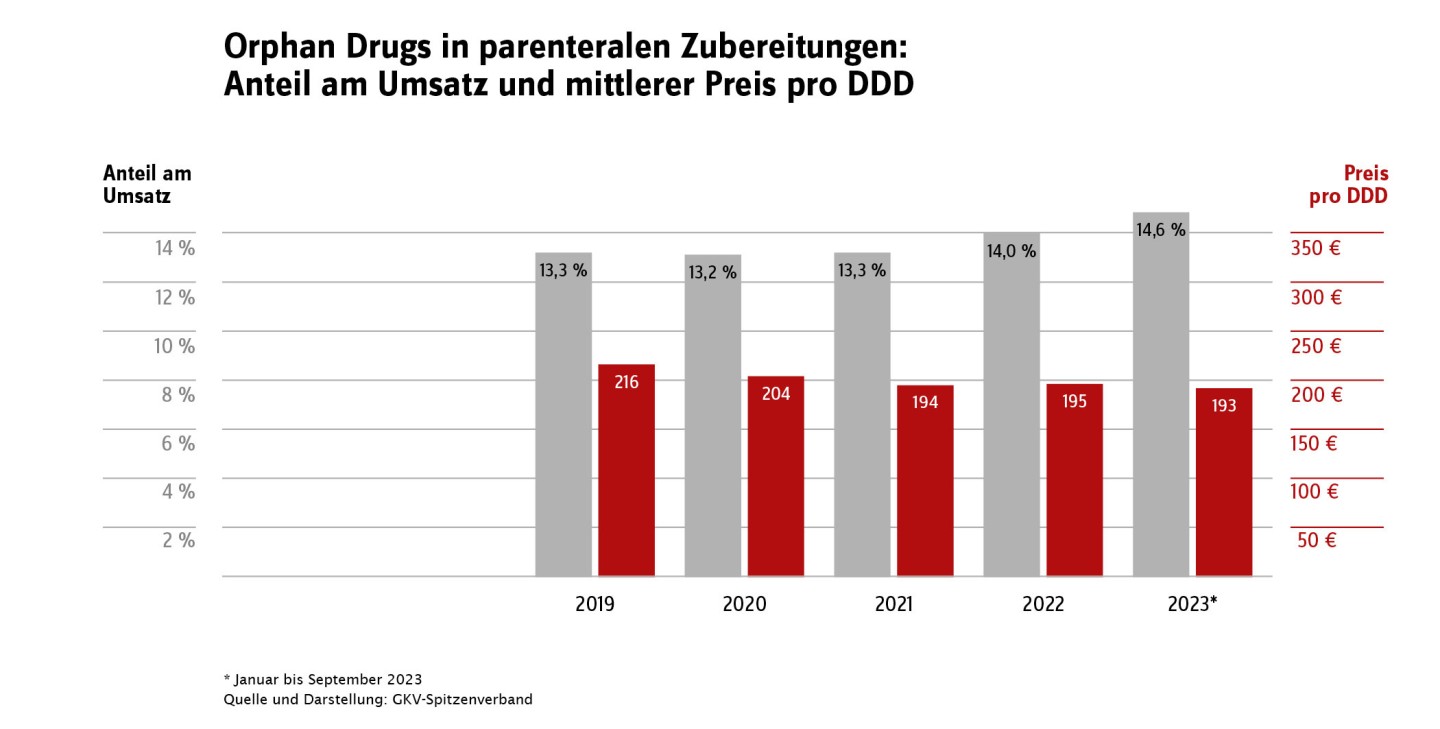
Aufgrund der besonderen Bedeutung des Marktsegments der Orphan Drugs enthält der aktuelle GAmSi-Bundesbericht in Tabelle 4 auch Angaben zu Bruttoumsatz und abgerechneten Tagesdosen (DDD). Der Anteil dieses Marktsegmentes, gemessen in Tagesdosen, ist gering. Im Zeitraum Januar bis September 2023 betrug er im Fertigarzneimittelbereich < 0,1 Prozent und bei den parenteralen Zubereitungen ca. 1,7 Prozent. Der Anteil am Gesamtarzneimittelumsatz ist mit ca. 5 Prozent im Fertigarzneimittelmarkt und über 14 Prozent für die parenteralen Zubereitungen jedoch deutlich größer. Entsprechend gibt es sowohl unter den 20 umsatzstärksten Fertigarzneimitteln (Tabelle 7; Ivacaftor/ Tezacaftor/ Elexacaftor und Tafamidis) als auch unter den 20 umsatzstärksten in parenteralen Zubereitungen verarbeiteten Wirkstoffen (Tabelle 12; Eculizumab, Daratumumab und Polatuzumab Vedotin) Orphan Drugs. Viele dieser Arzneimittel werden aufgrund ihres Anwendungsgebiets bei seltenen Erkrankungen auch nur sehr selten verordnet. Die Gruppe der Orphan Drugs ist nicht statisch: Neue Arzneimittel kommen hinzu, ältere Arzneimittel verlieren den Status als Orphan Drug, weil sie die Kriterien nicht mehr erfüllen bzw. weil der zehnjährige Geltungszeitraum endet.
Im Schnitt sind die Kosten pro Tagesdosis (DDD) für Orphan Drugs deutlich höher als für Nicht-Orphans; dies gilt sowohl für parenterale Zubereitungen als auch für den Fertigarzneimittelmarkt: Im Zeitraum von Januar bis September 2023 betrug der Unterschied bei parenteralen Zubereitungen 193 Euro/DDD zu 23 Euro/DDD, im Fertigarzneimittelmarkt aber schon 286 Euro/DDD zu 1 Euro/DDD. Insgesamt gibt es seit dem Jahr 2020 einen leichten Trend zu weniger verordneten DDD im Orphan-Segment des Fertigarzneimittelmarktes, die dabei gleichzeitig steigenden Kosten pro DDD halten den Bruttokosten-Anteil am Fertigarzneimittelmarktstabil bei ca. 5 Prozent: